Kozaki Ikko 小崎 一功
- 1992年生まれ
- 2017年3月 名古屋大学工学研究科 博士課程(前期課程)修了
- 2017年4月 名古屋大学工学研究科 博士課程(後期課程)進学
- 2019年4月 日本学術振興会 特別研究員(DC2)採用

ペプチドの細胞内機能評価システムの開発
複数のアミノ酸が結合してできる「ペプチド」は血圧降下作用や細胞増殖の促進、抗菌作用など様々な機能をもつ分子であり、医薬品や食品、化粧品など多くの分野で利用されています。特に細胞の中で機能するペプチドは、高い活性と副作用の少ない新薬となる可能性があり、候補分子として注目されています。しかし、細胞内で機能する有用なペプチドの探索には3つの課題があります。1つ目は、ペプチドはバリエーションが膨大であり、探索範囲が広いこと、2つ目は、ペプチドの多くは細胞内に入らず、機能評価が難しいこと、3つ目は、ペプチドを細胞内に送達するための分子の付加がペプチドの活性に影響することです。そのため、多種類のペプチドを細胞内に入れ、送達用分子の影響なく機能評価できるシステムが求められています。
本研究では、送達用分子が細胞内で外れ、ペプチド本来の細胞内機能を評価できるシステムを開発しました。本システムは多種類のペプチドの合成・評価が可能な「ペプチドアレイ技術」を用いて、「細胞透過性ペプチド(CPP)」と候補ペプチドを細胞内の還元環境で分解される「ジスルフィド結合」で架橋したペプチド複合体を多種類合成・評価できるものです(図1)。ジスルフィド結合の形成を選択的に行うために、リジンの主鎖、側鎖のアミノ基にそれぞれCPP、候補ペプチドを合成し、ジスルフィド形成を分子内反応にすることで目的のペプチド複合体を効率よく合成することに成功しました。
実際に開発したシステムを用いて、ペプチドの機能評価とペプチド配列の最適化が可能か検証しました。細胞内に入ることで、細胞死を誘導するペプチド(WELVVLGKL)を元に、1箇所ずつ他のアミノ酸18種で置換した全163種類のペプチドを作製し、評価しました。元ペプチドによる処理では、高い細胞死活性(細胞生存率=17.5%±5.8%)を示し、ペプチドが細胞内に入り、細胞死が誘導されることを確認できました。アミノ酸置換により、ペプチドの活性に変化が見られ、多種類のペプチドの機能評価が可能であることを示しました(図2)。また、元ペプチドと比較して細胞死活性が2倍向上したペプチドを同定し、高活性なペプチド取得に向けたペプチド配列の最適化に成功しました。
開発したシステムを用いて、様々な細胞内で機能するペプチドが発見され、ペプチドの医薬品応用につながることを期待しています。
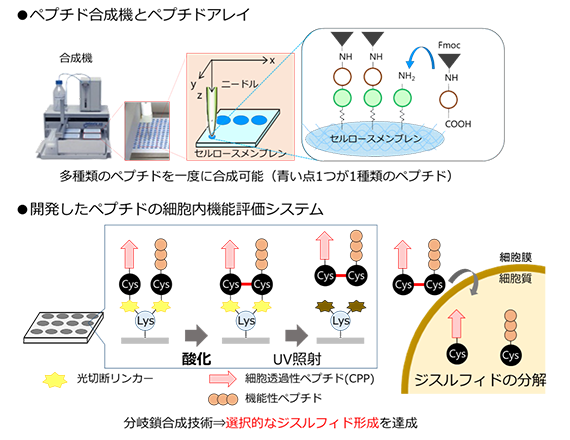
図1 ペプチド合成機とペプチドアレイ技術概要(上)、ペプチドアレイ技術、CPP、分岐鎖合成技術を用いたペプチドの細胞内機能評価システム(下)
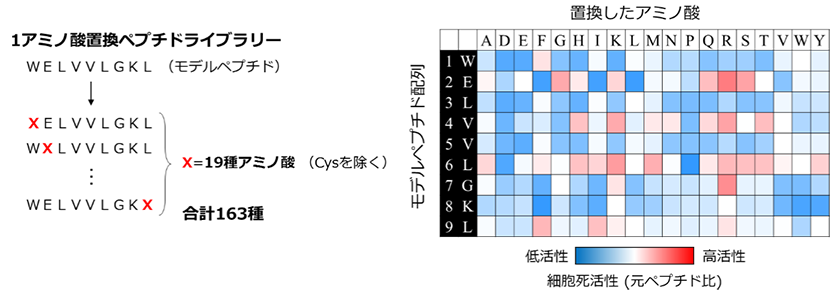
図2 細胞死誘導ペプチド(WELVVLGKL)の1アミノ酸置換ペプチドライブラリーの細胞死活性評価